Reversible Elektrochemische Speicher
Teil 2: Physikochemische Grundlagen der Anwendung und technischer Grenzen konventioneller Systeme: Dieser Artikel behandelt reversible elektrochemische Systeme, bei denen Stoff- und Phasenumwandlungen von Elektrodenmaterialien und Elektrolyten die Eigenschaften des jeweiligen Speichers dominieren. Unter dem Begriff „konventionelle Systeme“ werden in diesem Teil der Serie Blei-Säure-, Nickel-Cadmium, Nickel-Metallhydrid- und Lithium-Ionen-Speicher vorgestellt.
Energiespeicherung durch elektrochemische Stoffumwandlungen
Elektrochemische Energiespeicher nehmen elektrische Energie in Form von Elektronen auf und wandeln diese Energie in chemische Speicherformen um. Anders als bei physikalischen Speichern sind diese Umwandlungen immer an chemische Veränderungen, also Stoffumwandlungen gekoppelt. Diese Stoffumwandlungen laufen räumlich voneinander getrennt in den Halbzellen des Speichers ab (siehe Bild 2). Von der Kombination der Halbzellen-Reaktionen und ihrer Ausführung werden die Charakteristika jeder Speichertechnologie bestimmt. Zu- und Abflüsse elektrischer Energie sind untrennbar von chemischen Veränderungen begleitet. Der Austausch von Ladungen verändert die chemische Zusammensetzung der Stoffe und Materialien im Speicher und erfordert einen stofflichen Austausch innerhalb des Systems. Nur wenn die Stoffumwandlungen mit den Zu- und Abflüssen elektrischer Ladungen und der Richtungsumkehr von Stromflüssen mithalten können, liegen reversible Speicher oder Sekundärbatterien vor. Von Außen betrachtet kennzeichnet man die Quelle der negativen Ladungen als Minuspol, die Senke für negative Ladungen als Pluspol. Beim Ladungsaustausch mit Stromquellen oder Verbrauchern fließen durch beide Pole jeweils gleiche Ladungsmengen. Nimmt der Speicher elektrische Energie auf, fließen elektrische Ladungen am Minuspol in ihn hinein. Die dazugehörende Elektrode wird als positive Elektrode oder Kathode bezeichnet, die unmittelbare Umgebung als Kathodenraum. Vom Material, dass die positive Elektrode umgibt, werden Elektronen aufgenommen, die beteiligten Stoffe werden reduziert. Am Pluspol treten gleich viele Ladungen in den äußeren Stromkreis über, diese Ladungen stammen aus dem Material, das die negative Elektrode umgibt, die beteiligten Stoffe werden oxidiert. Diese Elektrode wird als Anode bezeichnet, der umgebende Raum als Anodenraum. Beide Räume sind von einem Elektrolyten erfüllt und durch einen Separator getrennt, der den Austausch von ionischen Ladungsträgern erlaubt und zudem Kurzschlüsse zwischen den Elektroden verhindern soll. Gibt der Speicher die aufgenommene Energie wieder ab, kehren sich die Prozesse um. An der Anode wird das Anoden-Speichermaterial oxidiert, Elektronen werden über den Minuspol abgegeben. An der Kathode wird das Kathoden-Speichermaterial reduziert, Elektronen werden über den Pluspol aufgenommen. Zwischen Anoden- und Kathodenraum diffundieren Austauschladungen in Form von Ionen durch die Elektrolytlösungen und durch den Separator. Die Triebkraft hinter diesen Reaktionen und damit hinter der Entladung des Speichers ist die freie chemische Energie der kombinierten Halbzellenreaktionen. In konventionellen Speichern spielen sich diese Reaktionen an Elektroden ab, die Elektroden und ihre Materialien sind also aktive Teilnehmer dieser Vorgänge und verändern dabei ihre chemischen Zusammensetzungen. Veränderungen der Mikrostrukturen und der makroskopischen Formen bleiben davon nicht unberührt und genau das führt zu den Grenzen im technischen Einsatz.
Blei-Säure-Speicher: die Klassiker
Für das Verständnis konventioneller Systeme kann der Blei-Säure-Speicher als Referenzpunkt betrachtet werden. Die Grundprinzipien und die daraus sich ergebenden Probleme im Einsatz für regenerative Energien finden sich auch bei anderen konventionellen Speichern. Die umgangssprachliche Bezeichnung „Blei-Akku“ verschleiert zwar die tatsächlich aktiven Materialien, bringt aber immer noch zum Ausdruck, dass die Elektrolytkomponente Schwefelsäure an den Halbzellenreaktionen beteiligt ist. Hier verändert der Ladungsfluss also auch die chemische Zusammensetzung des Elektrolyten.
Die elementaren Reaktionen spielen sich an den heterogenen Grenzflächen der Blei-Anode am Minuspol und der Bleidioxid-Kathode am Pluspol ab, die beide von wässriger Schwefelsäure benetzt werden. Die Konzentration dieses Elektrolyten ist idealerweise in beiden Halbzellen gleich. Die Stromableiter der Elektrodenmassen sind Gitter aus Blei-Antimon oder Blei-Kalzium-Legierungen und so dimensioniert, dass sie den Stromflüssen optimale Leiterbahnen bieten. Die Gitterstruktur der negativen Elektrode ist mit Bleischwamm, die Gitterstruktur der positiven Elektrode mit fein verteiltem Bleidioxid gefüllt.
Beim Entladen gibt das elementare Blei in der negativen Elektrodenmasse Elektronen ab und wird zum zweiwertigen Blei-Ion oxidiert. Die an der Oberfläche freigesetzten Blei-Ionen reagieren sofort mit Sulfat-Ionen der Schwefelsäure zu einer schwerlöslichen Kruste von Bleisulfat. Die Entladung kann so lange weitergehen, als noch Blei-Ionen durch die aufwachsende Bleisulfatschicht diffundieren und mit Schwefelsäure reagieren können. Irgendwann ist damit Schluss und die Entladung des Speichers kommt zum Erliegen. Das Bleidioxid der positiven Elektrodenmasse nimmt beim Entladen Elektronen auf, wird zu zweiwertigen Blei-Ionen und Wasser reduziert und reagiert mit Sulfat-Ionen aus dem Elektrolyten zu Bleisulfat. Auch diese Reaktion kommt zum Erliegen, wenn die aufwachsende Kruste aus Bleisulfat zu undurchdringlich für Blei- und Sulfat-Ionen wird.
Je nach Entladestrom und Entladezustand stellt der Blei-Säure-Speicher eine Spannung von 1,75–2,4 Volt zur Verfügung. Die praktisch erreichbaren Energiedichten liegen bei 30 kWh/kg.
Mit fortschreitender Entladung des Speichers verändern die ursprünglich eingesetzten Materialien ihre Zusammensetzung und es entsteht auf beiden Elektrodenmassen Bleisulfat, das ortsfest bleibt. Aus den Eigenschaften des aufwachsenden Bleisulfats ergibt sich eine praktische untere Grenze für die Tiefentladung. Werden die Ablagerungen zu mächtig, sinkt die Leitfähigkeit innerhalb der Sulfatschichten, außerdem kann es frühzeitig zu einer Vergröberung der Strukturen und damit zu einem Verlust an Oberfläche kommen. Deswegen gibt es eine praktische untere Entladegrenze und die Beschränkung auf maximal 75-80% der theoretischen Entladekapazität. Bei der Entladung wird die Schwefelsäure verbraucht und es entsteht zusätzlich Wasser, das den Elektrolyten verdünnt. Die Dichte der Batteriesäure ist bei Entladeschluss minimal und kann als Maß für den Ladezustand des Speichers gemessen werden. Diese Messungen lassen sich bei Bedarf bis auf das Niveau von Primärzellen ausführen, so dass der Ladezustand auch der kleinsten Einheit prinzipiell sensorisch erfasst werden kann. Beim Aufladen laufen die oben beschriebenen Elementarprozesse in umgekehrter Richtung ab, solange Bleisulfat für die elektrochemische Umwandlung zur Verfügung steht. Ist alles Bleisulfat verbraucht und werden Ladestrom und -spannung nicht reguliert, kommt es an der negativen Elektrodenmasse zur Reduktion von Protonen und zur Freisetzung von Wasserstoff, an der positiven Elektrodenmasse zur Oxidation von Wasser und zur Freisetzung von Sauerstoff: Der Speicher gast und Wasser wird irreversibel verbraucht.
Nur dank der sehr geringen Löslichkeit des Bleisulfats in der wässrigen Schwefelsäure und dank der guten Haftung sowohl auf Blei als auch auf Bleidioxid ist der Bleiakku in der einfachen und robusten Ausführung, wie sie die mobilen und stationären Ausführungen erfordern, überhaupt machbar. Bleisulfat hat gerade die richtige Löslichkeit in wässriger Schwefelsäure und ist darüber hinaus unter den Betriebsbedingungen des Akkus hinreichend leitfähig. Wäre diese Bleiverbindung nur etwas besser löslich, würde sich ein geladener Akku sehr schnell selbst entladen. Würde man die Schwefelsäure gegen Phosphorsäure austauschen, so würde sich praktisch unlösliches Bleiphosphat bilden. In diesem Material wären Blei-Ionen irreversibel gespeichert und der hypothetische Blei-Phosphorsäure-Akku könnte in endlicher Zeit nicht mehr aufgeladen oder entladen werden. Ein Blei-Phosphorsäure-Akku ist also auch hypothetisch nicht denkbar. Der Elektrolyt im konventionellen Blei-Säure-Akku kann also nicht beliebig ausgetauscht werden, es kommt in diesem Fall auf das Anion an, damit sich eine geeignete intermediäre Speicherform für das Entladungsprodukt ausbilden kann. Das Blei im Bleiakku liegt damit nur lokal und chemisch in den gerade notwendigen Konzentrationen vor. Die Gefahr beim Auslaufen eines Bleiakkus hat also nichts mit dem Gehalt an Blei in der Elektrolytlösung, als vielmehr mit der Konzentration der Schwefelsäure zu tun.
Die Aufladung dieses Speichers hat die elektrische Energie in elementares, metallisches Blei und in Bleidioxid umgesetzt. Letzteres zersetzt sich, sobald keine Spannung mehr anliegt und insbesondere bei höheren Temperaturen, unter Reaktion mit dem Elektrolyten. Dabei entsteht wieder ortsfestes Bleisulfat und als weiteres Reaktionsprodukt Sauerstoff. Der Sauerstoff kann durch Diffusion zur negativen Elektrode gelangen und dort zu Wasser umgesetzt werden. Dort löst sich in dem Maße Blei auf und wird als Bleisulfat niedergeschlagen, wie Sauerstoff nachdiffundiert. Bei längerem Stehen entlädt sich ein Bleiakku über diesen inneren Kurzschluss also selbst – umso schneller, je höher die Temperatur ist. Um ein Kaputtstehen des Speichers zu verhindern, wird er mit einer Schwebeladung betrieben, die diesen Selbstentladeprozessen entgegenwirkt. Bei tiefen Temperaturen wird die Zersetzung der positiven Elektrodenmasse noch weiter verlangsamt, die Beweglichkeit der Sulfat- und Blei-Ionen wird nun aber so gering, dass die Elektrodenprozesse zum Erliegen kommen. Zur Minderung der Selbstentladung und zur Aufrechterhaltung der Ionenbeweglichkeit werden Blei-Säure-Speicher daher zweckmäßig auf 20–25°C temperiert.
Nickel-Cadmium-Speicher: Sonderlösung für extreme Anforderungen
Die Kapazität für die Speicherung elektrischer Ladung im Nickel-Cadmium-Speicher beruht auf positiven Elektrodenmassen aus Nickeloxid und negativen Elektrodenmassen aus metallischem Cadmium. Die prinzipiellen Strukturen sind vergleichbar mit denen des Blei-Säure-Speichers (siehe Bild 3). Beide Halbzellen enthalten Kalilauge als Elektrolyt und werden durch poröse Separatoren voneinander getrennt. In den Lade- und Entladereaktionen der Halbzellen wird unlösliches Cadmiumhydroxid zu metallischem Cadmium, respektive unlösliches Nickelhydroxid zu festem Nickeloxidhydroxid umgewandelt. Der Elektrolyt ist dabei an den Reaktionen beteiligt, wird aber in der Bilanz weder beim Lade- noch beim Entladevorgang verbraucht. Die Verfolgung des Ladezustands ist also nicht durch die Messung der Elektrolytdichte möglich.
Der Nickel-Cadmium-Speicher ist durch die asymmetrische Dimensionierung seiner Elektrodenmassen gegen Überladung geschützt. Die negative Elektrode ist größer dimensioniert als die positive Elektrodenmasse. Wie beim Blei-Säure-Speicher können an der positiven Elektrode nur so lange Ladungen gespeichert werden, als Nickelhydroxid zur Verfügung steht; ist dieses Material aufgebraucht, wird das Wasser des Elektrolyten oxidiert und es entsteht gasförmiger Sauerstoff. Durch Diffusion zur negativen Elektrode kann er dort mit metallischem Cadmium zu Cadmiumhydroxid reagieren und es stellt sich ein Gleichgewicht ein, solange die Produktion von Sauerstoff und die Überladung nicht zu gross werden. Die Lebensdauer und die Belastbarkeit des Nickel-Cadmium-Speichers ist bis heute von keinem vergleichbaren System übertroffen worden. Dabei stechen besonders die Robustheit gegen Tiefentladungen und die Lieferung hoher Ströme auch bei tiefen Temperaturen hervor. Lagerungen im entladenen Zustand schaden ihm nicht. Bedingt durch die Materialien und die Herstellungsprozesse wird er aber auch in Zukunft zu den teuersten konventionellen Speichersystemen gehören. Wegen der Umwelt- und Humantoxizität des metallischen Cadmiums sind die Anwendungen aus guten Gründen auf Kleinakkumulatoren beschränkt und sollen durch Nickel-Metallhydrid-Speicher ersetzt werden.
Die Teilspannungen der Halbzellenreaktionen addieren sich zu einer Zellspannung von ca. 1,3 V, die praktisch erreichbaren Energiedichten liegen bei 45 bis 50 Wh/kg.
Der Gedanke, die gut verstandene Nickeloxidhydroxid-Halbzelle beizubehalten und das toxikologisch problematische Cadmium durch Zink zu ersetzen, ist naheliegend und wurde auch ausprobiert. Noch dazu würde man durch das leichtere Zink Vorteile für die Energiedichte gewinnen. Zink muss als Anodenmasse in poröser Form im Kontakt mit dem alkalischen Elektrolyten stehen, zur Unterdrückung von Wasserstoffentwicklung bei Überladung muss allerdings Bleioxid zugesetzt werden. Auch hat sich herausgestellt, dass das metallische Zink in den Anodenstrukturen einen „Haftgrund“ aus Blei braucht. Der Ersatz toxischer Schwermetalle gelingt also nicht vollständig. Der wichtigste Grund, warum diese Kombination sich noch nicht hat umsetzen lassen, ist die Formänderung der Zinkverbindungen beim Durchlaufen der Lade- und Entladezyklen. Der Ausweg, Zink-Anoden oder einen alkalischen Zink-Speicher mechanisch komplett auszuwechseln, ist aus Wirtschaftlichkeitsgründen auch innerhalb der nächsten Dekade nicht umsetzbar.
Nickel-Metallhydrid-Speicher: eine Spielart der Wasserstoff-Technologie
Das Redoxpaar Nickeloxidhydroxid-Nickelhydroxid lässt sich als alkalisches System sehr gut mit Wasserstoff als Elektronenlieferant kombinieren. Wasserstoff kann reversibel in einer Nickel-Seltenerdmetall-Legierung zwischengespeichert werden, weil es in diesen Legierungen Metallhydride bilden kann. Mit diesen Materialien hat man einen sehr kompakten Wasserstoffspeicher als technisches Material zur Verfügung, der wie ein metallischer Werkstoff verarbeitet werden kann. Durch eine Reihe von unterschiedlichen Legierungen ist die Speicherfähigkeit für Wasserstoff respektive der elektrochemisch verfügbare Energieinhalt immer größer als der einer vergleichbar großen Anodenmasse aus Cadmium. Aus fein gemahlenen Metallpulvern werden poröse Anodenmassen gefertigt und mit standardmäßig verfügbaren Nickel-Materialien zu Nickel-Metallhydrid-Zellen kombiniert. Die so realisierbaren Zellen können Nickel-Cadmium-Speicher direkt ersetzen, da die Spannungen mit ca. 1,2 V nahezu gleich sind. Als erheblicher Vorteil ergibt sich eine höhere Energiedichte, mit bis zu 50–90 Wh/kg
ist die gravimetrische Energiedichte in technischen Produkten immer höher als in Nickel-Cadmium-Speichern. Die wiederholte Aufnahme und Abgabe von Wasserstoff in den Anodenmassen führen zu einer zunehmenden Verkleinerung der Materialpartikel in den Anodenmassen, die elektrische Kontaktierung und die Formstabilität sind und bleiben eine materialbedingte Ursache für die begrenzte Langzeitstabilität. Die Selbstentladerate ist ähnlich hoch wie beim Nickel-Cadmium-Speicher und ist auf die Reaktion der positiven Kathodenmassen mit dem Elektrolyten, unter Freisetzung von Sauerstoff, zurückzuführen. Der Sauerstoff kann in die Anodenmassen eindiffundieren und dort zur Passivierung der Speicherlegierung beitragen. Für hohe Zyklenstabilität und lange Lebensdauern sind deswegen speziell abgestimmte Ladegräte, für größere Speicherpakete spezifisch abgestimmte elektronische Steuerungen erforderlich. Aus der einzelnen Speicherzelle wird bei Zusammenfügen größerer Speicherblöcke unweigerlich ein neues System, mit der Steuer- und Regelinstanz des elektronischen Batteriemanagementsystems. Darin liegt ein bisher nicht genügend beachteter Kostenfaktor begründet – durch den Übergang zum Speichersystem müssen zwangsläufig neue Kosten-Kurven geschaffen werden, wodurch die tatsächlichen Kostenvorteile der einzelnen Speicherzelle neutralisiert werden können.
Anmerkung: Nur wenn die Lebensdauer und Zyklenstabilität größerer Speicherpakete möglichst kostenneutral durch Batteriemanagementsysteme gesteigert wird, kann es gelingen, konventionelle elektrochemische Speicher für die Elektromobilität und für Netzfunktionen weiter zu verbreiten. Unter diesen Umständen wären große Entwicklungssprünge in der angewandten Elektrochemie und den Materialwissenschaften nicht mehr der dominierende Faktor für den kommerziellen Erfolg der konventionellen Speichertechnologien.
Lithium-Ionen-Speicher: neue Materialien und die Leistungsgrenzen konventioneller Systeme
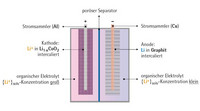
Lithium, als elektropositivstes Metall in der elektrochemischen Spannungsreihe, erlaubt aussichtsreiche Halbzellenkombinationen mit hohen Spannungen. Gleichzeitig ist es unter den elektrochemischen Bedingungen, als Anodenmaterial in einer negativen Halbzelle, chemisch sehr reaktiv und als metallische Elektrode nur schwer ohne Formverluste kontrollierbar. Als kleinstes und leichtestes Alkalimetall ist es nicht nur das leichteste Metall überhaupt, sondern bildet bei der Abgabe von Elektronen auch die kleinsten Metall-Ionen, die man kennt: Lithium-Ionen kommen buchstäblich überall hin und brauchen wenig Platz. Das sind die wesentlichen Gründe für die Attraktivität dieses chemischen Elements in der Energiespeicherung. Aus genau denselben Gründen ist es aber nicht mehr möglich, mit herkömmlichen Materialien und Produktionsmethoden zu arbeiten. Lithium ist gegenüber Wasser und Sauerstoff sehr reaktiv und neigt mit vielen molekularen Lösungsmitteln zu irreversiblen chemischen Reaktionen. Die Energiedichten einer Lithium-Halbzelle müssen auch mechanisch vor dem Abfluss über interne Kurzschlüsse geschützt sein, die Folgen einer mechanischen Beschädigung von Separatoren oder des Containments können spektakulär sein. In Bild 4 sind die wichtigsten strukturellen und funktionellen Elemente eines Lithium-Ionen-Speichers dargestellt. Die negative Halbzelle besteht typischerweise aus Graphitmaterial, eingebettet in eine Stromableiterstruktur. Zwischen die Schichten des Graphits ist metallisches Lithium eingebaut. Diese Einlagerungsverbindung von Lithium in Graphit ist nun in der Lage, Elektronen abzugeben, die zurückbleibenden Lithium-Ionen stoßen sich in den Schichten gegenseitig ab und wandern in den Elektrolyten. Der Entladeprozess hinterlässt ein Schichtmaterial, das an Lithium verarmt ist und bei Unterschreitung einer bestimmten Lithiumkonzentration seine offene Struktur verliert.
Das Material der positiven Halbzelle besteht aus einem Mischoxid, dessen Kristallgitter von Lithium- und Übergangsmetallionen, beispielsweise Titan, Mangan, Eisen oder Cobalt aufgebaut wird. Die Oxidationsstufen und damit die Ladung der Übergangsmetallzentren sind veränderbar, wird die Ladung eines solchen Zentrums durch elektrochemische Reduktion um eine Einheit verringert, kann aus dem Elektrolyten ein Lithium-Ion in das Kristallgitter einwandern und die Ladungsneutralität wiederherstellen. Der Ladeprozess erzeugt ein Material, das mehr Lithium-Ionen als zu Beginn aufweist. Bei Ladungsentzug über den Stromsammler läuft der Vorgang umgekehrt ab und Lithium-Ionen treten aus dem Festkörper in den Elektrolyten über. Beim Entladen wandern Lithium-Ionen aus der Schichtstruktur in den Elektrolyten und von dort, durch den mechanischen Separator, zur positiven Elektrode, wo sie in das Wirtgitter der Kathodenmasse eingebaut werden. Beim Entladeprozess kommt es, bildhaft ausgedrückt, zum Stau von Lithium-Ionen vor den Eingängen des Kathodenmaterials, beim Laden zum Stau vor den Eingängen des Anodenmaterials.
In Abhängigkeit vom Kathodenmaterial liefern Lithium-Ionen-Speicher eine Entladespannung von 3,3–3,6 Volt und realisieren derzeit Energiedichten von ca. 150 Wh/kg.
Da die Lithium-Ionen als kleinste Metall-Ionen überhaupt eine starke anziehende Wirkung auf die Lösungsmittelkomponenten des Elektrolyts ausüben, treten im Laufe der Entladung und Aufladung an beiden Elektrodenmaterialien lokal stark erhöhte Konzentrationen von Lithium-Solvat-Komplexen auf und gehen zum Teil irreversible Oxidations- und Reduktionsprozess ein. In der Folge können sich polymere Abbauprodukte des Elektrolyts an der Oberfläche der Elektrodenmassen ansammeln, bis hin zur weitgehenden Blockade der mikrostrukturellen Poren der Wirtsmaterialien. Neben Kapazitätsverlusten können starke lokale Erwärmungen beim Laden oder Entladen die Folge sein, was bis zum Durchbruch von „Hot Spots“ und der Zerstörung des Speichers in einer unkontrollierbaren exothermen Reaktion führen kann. Diesen Gefahren kann man durch den Wechsel zu chemisch weniger reaktiven Kathodenmassen und der Verbesserung der Elektrolytchemie vorbeugen, komplett vermeidbar sind diese Gefahren allerdings nicht. Auch hier ist bereits für den langzeitoptimierten sicheren Betrieb einer einzigen Primärzelle ein Batteriemanagement-System notwendig, welches die Alterung der Zelle erkennt und Lade- wie Entladeprozesse entsprechend anpasst.
Ausblick auf neue Systeme
Ob es es gelingt, aus den hier beschriebenen konventionellen Primärzellen grosse Speicherpakete aufzbauen und kostenoptimiert an deren theoretisch mögliche Lebensdauern zu führen, wird die Praxis der nächsten Jahre zeigen. Auswege aus diesen Beschränkungen sind in der Evolution nicht-konventioneller Systemen erkennbar, mit denen völlig neue Pfade aufgemacht werden: elektrochemische Speicher, deren Elektroden nicht mehr ermüdet oder verbraucht werden, strukturell selbstorganisierende Speicher mit flüssigen Elektroden und billigen, strategisch nicht limitierten Materialien. Möglicherweise rückt die Vision von skalierbaren Speichern für die Netzanbindung damit in greifbare Nähe.
Dr. Markus Wolf